Trong môn hóa học, chúng ta đã được học về cách các electron được sắp xếp trong các lớp vỏ/quỹ đạo khác nhau của nguyên tử. Những electron có mặt ở lớp vỏ/quỹ đạo ngoài cùng được gọi là các electron hóa trị.
- Biến trở: Thông tin về công dụng và ứng dụng trong công nghiệp và đời sống hàng ngày
- Tạn mạn về Biểu đồ tần số đáp tuyến – Hướng dẫn đọc và sử dụng
- Nguồn tổ ong 12V 5A: Uy tín, chất lượng và bảo hành 1 năm tại TPHCM
- Nguồn Xung: Khám phá khái niệm, cấu tạo và nguyên lý hoạt động
- Ngắn mạch: Hiện tượng và cách khắc phục
Trong tất cả các phản ứng hóa học, chỉ các electron có trong quỹ đạo ngoài cùng mới tham gia vào phản ứng. Vì chúng có xuất hiện xa nhất từ hạt nhân, lực hút của hạt nhân lên chúng cũng là nhỏ nhất.
Bạn đang xem: Tìm hiểu về hóa trị và electron hóa trị
Theo sơ đồ Bohr-Bury, lớp vỏ ngoài cùng của một nguyên tử có thể chứa tối đa 8 electron. Tuy nhiên, helium và hydro là ngoại lệ, vì chúng chỉ có thể có hai electron ở lớp vỏ.
Contents
Khái niệm hóa trị
Hóa trị là khả năng kết hợp của một nguyên tử. Nó luôn là một con số nguyên, không có dấu cộng hoặc dấu trừ. Electron có mặt ở lớp vỏ ngoài cùng của nguyên tử được gọi là “electron hóa trị”. Hóa trị có thể coi là số lượng electron mà một nguyên tử có thể mất hoặc nhận để đạt được sự ổn định.
Hóa trị thường được sử dụng để viết công thức hóa học. Nó giúp chúng ta biết cách các nguyên tử của các nguyên tố sẽ kết hợp với nhau.
.png)
Ý tưởng và quy tắc bát tử
Trong một nguyên tử, các electron quay quanh hạt nhân theo các quỹ đạo khác nhau (lớp vỏ). Các quỹ đạo được ký hiệu là K, L, M, N… Như đã đề cập trước đó, những electron hóa trị còn lại ở lớp vỏ ngoài cùng của nguyên tử. Những electron này thường tham gia vào các phản ứng hóa học vì chúng chứa nhiều năng lượng hơn các electron ở các quỹ đạo khác.
Theo quy tắc bát tử, lớp vỏ ngoài cùng của một nguyên tử có thể chứa tối đa 8 electron để trở nên ổn định. Tuy nhiên, nếu lớp vỏ ngoài cùng đã đầy, thì ít hoặc không có phản ứng hóa học nào được quan sát thấy.
Hóa trị của một nguyên tử
Xem thêm : Cách đấu điện 3 pha cho gia đình đúng kỹ thuật
Khái niệm về hóa trị phát sinh từ nghiên cứu về các nguyên tố trơ, còn được gọi là khí hiếm. Các nguyên tố này có 8 electron hóa trị trong lớp vỏ ngoài cùng, trừ helium chỉ có 2 electron.
Tất cả các nguyên tố khác đều có ít hơn 8 electron trong lớp vỏ hóa trị của chúng.
Các nguyên tử này muốn đạt được sự ổn định bằng cách mất, nhận hoặc chia sẻ electron với các nguyên tử khác để hoàn thành bộ tám của chúng. Do đó, hóa trị của một nguyên tử có thể được xác định bằng:
“Khả năng kết hợp của nguyên tử của một nguyên tử được gọi là hóa trị” hoặc “Số lượng electron mà nguyên tử có thể mất, nhận hoặc chia sẻ để hoàn thành bộ tám (hoặc bộ đôi) của nó để đạt được sự ổn định được gọi là hóa trị của nguyên tử”.

Cách tính hóa trị
Để tính hóa trị của một nguyên tử, chúng ta cần viết cấu hình electron của nó trước. Hóa trị của một nguyên tử có thể được tính theo cách sau:
- Đối với các nguyên tử có 1, 2, 3, 4 electron trong lớp vỏ hóa trị của chúng, hóa trị tương ứng với số electron có trong lớp vỏ hóa trị.
- Đối với các nguyên tử có nhiều hơn 4 electron trong lớp vỏ hóa trị của chúng, hóa trị có thể được tính bằng công thức: Hóa trị = 8 – Số electron hóa trị.
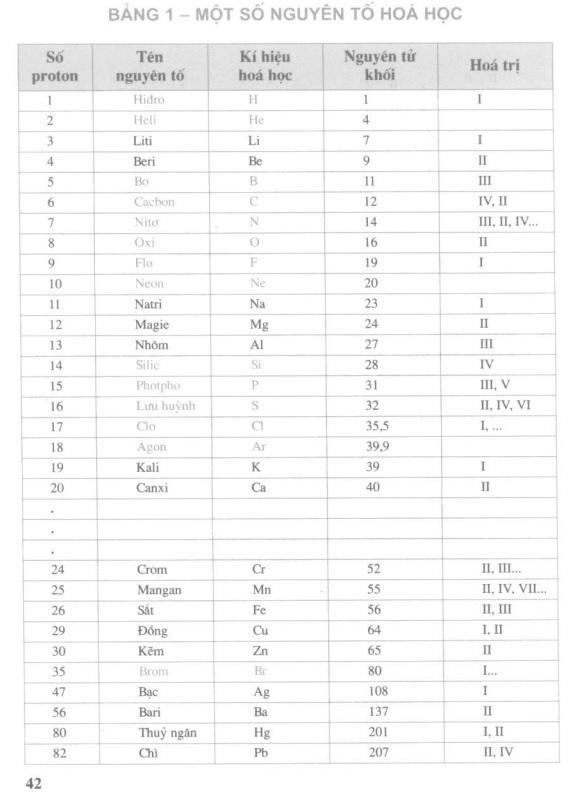
Bảng hóa trị trang 42 của sách giáo trình lớp 8 là một nguồn thông tin quan trọng, nó liệt kê hóa trị của 30 nguyên tố phổ biến nhất. Bảng hóa trị này được sử dụng trong cả giảng dạy hóa học ở trình độ trung học cơ sở và trung học phổ thông.
| Tên nguyên tố | Số hiệu nguyên tử | Hóa trị |
|---|---|---|
| Hydrogen(H) | 1 | 1 |
| Helium(He) | 2 | 0 |
| Lithium(Li) | 3 | 1 |
| Beryllium(Be) | 4 | 2 |
| Boron(B) | 5 | 3 |
| Carbon(C) | 6 | 4 |
| Nitrogen(N) | 7 | 3 |
| Oxygen(O) | 8 | 2 |
| Fluorine(F) | 9 | 1 |
| Neon(Ne) | 10 | 0 |
| Sodium(Na) | 11 | 1 |
| Magnesium(Mg) | 12 | 2 |
| Aluminium(Al) | 13 | 3 |
| Silicon(Si) | 14 | 4 |
| Phosphorus(P) | 15 | 3 |
| Sulphur(S) | 16 | 2 |
| Chlorine(Cl) | 17 | 1 |
| Argon(Ar) | 18 | 0 |
| Potassium(K) | 19 | 1 |
| Calcium(Ca) | 20 | 2 |
| Scandium(Sc) | 21 | 3 |
| Titanium(Ti) | 22 | 4 |
| Vanadium(V) | 23 | 5,4 |
| Chromium(Cr) | 24 | 2 |
| Manganese(Mn) | 25 | 7,4,2 |
| Iron(Fe) | 26 | 2,3 |
| Cobalt(Co) | 27 | 3,2 |
| Nickel(Ni) | 28 | 2 |
| Copper(Cu) | 29 | 2,1 |
| Zinc(Zn) | 30 | 2 |
Bảng hóa trị giúp chúng ta xác định số nguyên tử của một nguyên tố kết hợp với một nguyên tố khác để tạo thành bất kỳ công thức hóa học nào. Một ứng dụng quan trọng khác của hóa trị là tìm công thức của các hợp chất.
Nếu biết hóa trị của các nguyên tố, chúng ta có thể nhanh chóng viết công thức của các hợp chất này.
Ví dụ:
Công thức của hợp chất tetraclorua cacbon(CCl4):
Kí hiệu của cacbon là C, clo là Cl. Hóa trị của chúng lần lượt là 4 và 1. Vậy công thức của hợp chất tetraclorua cacbon sẽ là CCl4 vì: Cacbon nhận bốn electron và clo mất một electron để hoàn thành bộ tám của chúng.
Công thức của hợp chất clorua magie(MgCl2):
Kí hiệu của magie là Mg, của clo là Cl. Hóa trị của chúng lần lượt là 2 và 1. Vậy công thức của hợp chất clorua magie sẽ là MgCl2 vì: Magie mất hai electron và clo nhận một electron để tạo thành hợp chất.
XEM THÊM:
Tại sao chúng ta cần hóa trị?
Hóa trị quyết định mức độ mạnh mẽ của liên kết giữa các nguyên tử, chúng ta cần biết hóa trị để hiểu cách các nguyên tử kết hợp với nhau. Nếu hóa trị càng cao, thì liên kết càng mạnh. Điều này giải thích tại sao các nguyên tử có độ bền cao thường được sử dụng trong các phản ứng hóa học, vì chúng tạo thành liên kết mạnh với các nguyên tử khác.

Hóa trị có dấu không?
Mất electron hoặc nhận electron được gọi là điện tích của nguyên tử. Điện tích dương được tạo ra bằng cách tặng một electron và điện tích âm được tạo ra bằng cách nhận electron. Vì vậy, hóa trị không có dấu, và oxy hóa có thể có cả dấu âm và dương.
Bài viết liên quan: Bảng tuần hoàn các nguyên tố hóa học lớp 8
Nguồn: https://cite.edu.vn
Danh mục: Học tập